L'IPTG (isopropyl-β-D-thiogalactoside) est un analogue du substrat de la β-galactosidase, qui est hautement inductible.Sous l'induction de l'IPTG, l'inducteur peut former un complexe avec la protéine répresseur, de sorte que la conformation de la protéine répresseur soit modifiée, de sorte qu'elle ne puisse pas être combinée avec le gène cible, et que le gène cible soit exprimé efficacement.Alors, comment déterminer la concentration d’IPTG au cours de l’expérience ?Est-ce que plus c'est gros, mieux c'est ?
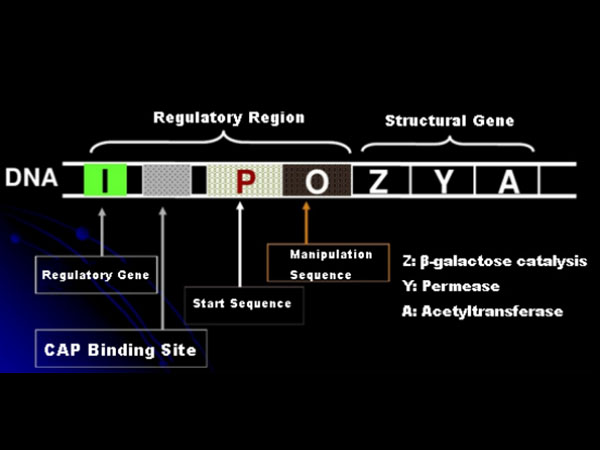
Tout d'abord, comprenons le principe de l'induction de l'IPTG : l'opéron lactose (élément) d'E. coli contient trois gènes structurels, Z, Y et A, qui codent respectivement pour la β-galactosidase, la perméase et l'acétyltransférase.lacZ hydrolyse le lactose en glucose et galactose, ou en allo-lactose ;lacY permet au lactose présent dans l'environnement de traverser la membrane cellulaire et de pénétrer dans la cellule ;lacA transfère le groupe acétyle de l'acétyl-CoA au β-galactoside, ce qui implique la suppression de l'effet toxique.De plus, il existe une séquence opérationnelle O, une séquence de départ P et un gène régulateur I. Le code du gène I est une protéine répresseur qui peut se lier à la position O de la séquence opérateur, de sorte que l'opéron (méta) soit réprimé et éteindre.Il existe également un site de liaison pour le site de liaison protéine activatrice du gène catabolique-CAP en amont de la séquence initiatrice P. La séquence P, la séquence O et le site de liaison CAP constituent ensemble la région régulatrice de l'opéron lac.Les gènes codants des trois enzymes sont régulés par la même région régulatrice pour obtenir l'expression coordonnée des produits géniques.
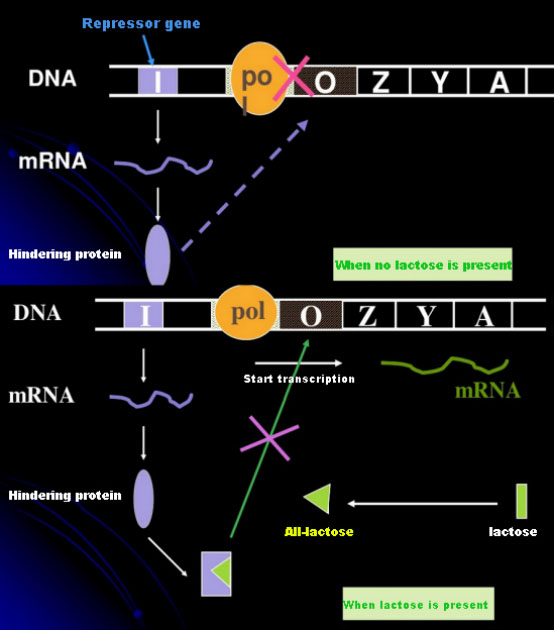
En l’absence de lactose, l’opéron lac (méta) est en état de répression.A ce moment, le répresseur lac exprimé par la séquence I sous le contrôle de la séquence promotrice PI se lie à la séquence O, ce qui empêche l'ARN polymérase de se lier à la séquence P et inhibe l'initiation de la transcription ;lorsque le lactose est présent, l'opéron lac (méta) peut être induit. Dans ce système d'opéron (méta), le véritable inducteur n'est pas le lactose lui-même.Le lactose pénètre dans la cellule et est catalysé par la β-galactosidase pour être converti en allolactose.Cette dernière, en tant que molécule inductrice, se lie à la protéine répresseur et modifie la conformation de la protéine, ce qui conduit à la dissociation de la protéine répresseur de la séquence O et à la transcription.L'isopropylthiogalactoside (IPTG) a le même effet que l'allolactose.C’est un inducteur très puissant, non métabolisé par les bactéries et très stable, c’est pourquoi il est largement utilisé dans les laboratoires.
Comment déterminer la concentration optimale d’IPTG ?Prenons E. coli comme exemple.
La souche E. coli BL21 génétiquement modifiée contenant le pGEX recombinant positif (CGRP/msCT) a été inoculée dans un milieu liquide LB contenant 50 μg.mL-1 Amp et cultivée pendant une nuit à 37°C.La culture ci-dessus a été inoculée dans 10 flacons de 50 ml de milieu liquide LB frais contenant 50 μg·mL-1 Amp dans un rapport de 1:100 pour la culture par expansion, et lorsque la valeur OD600 était de 0,6 à 0,8, de l'IPTG a été ajouté à la concentration finale.C'est 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Après induction à la même température et en même temps, 1 ml de solution bactérienne en a été prélevé, et les cellules bactériennes ont été collectées par centrifugation et soumises à SDS-PAGE pour analyser l'influence de différentes concentrations d'IPTG sur l'expression des protéines, puis sélectionnez la concentration d’IPTG avec la plus grande expression protéique.
Après expériences, on constatera que la concentration en IPTG n'est pas aussi grande que possible.En effet, l'IPTG présente une certaine toxicité pour les bactéries.Dépasser la concentration tuera également la cellule ;et d'une manière générale, nous espérons que plus la protéine exprimée dans la cellule est soluble, mieux c'est, mais dans de nombreux cas, lorsque la concentration d'IPTG est trop élevée, une grande quantité d'inclusion se formera.Corps, mais la quantité de protéines solubles a diminué.Par conséquent, la concentration d’IPTG la plus appropriée n’est souvent pas la plus élevée, mais la plus faible.
Le but de l’induction et de la culture de souches génétiquement modifiées est d’augmenter le rendement de la protéine cible et de réduire les coûts.L'expression du gène cible n'est pas seulement affectée par les facteurs propres à la souche et le plasmide d'expression, mais également par d'autres conditions externes, telles que la concentration de l'inducteur, la température d'induction et le temps d'induction.Par conséquent, en général, avant qu’une protéine inconnue ne soit exprimée et purifiée, il est préférable d’étudier le temps d’induction, la température et la concentration en IPTG afin de sélectionner les conditions appropriées et d’obtenir les meilleurs résultats expérimentaux.
Heure de publication : 31 décembre 2021

